我校交叉科学研究院团队成功研发高仿生人源肝脏类器官
发布时间:2025.12.14点击:10
近日,我校交叉科学研究院葛广波、郭兆彬团队在国际知名期刊Advanced Science上在线发表了题为“Novel Vascularized Human Liver Organoids for Modeling Alcohol-Induced Liver Injury and Developing Hepatoprotective Therapy”的研究性论文。该研究团队成功构建了一种新型人源血管化肝脏类器官(3HLOs),该类器官不仅能精准模拟酒精性肝病发生发展过程中的关键分子事件与病理进程,还在保肝药物的筛选与评价、以及终末期肝病的再生医学治疗方面表现出良好的应用潜力。

肝脏作为人体的核心代谢器官,其功能的正常运转依赖于内部精密的多脉管网络结构。然而,现有肝脏类器官大多缺乏功能性血管和胆管结构,难以真实模拟人体肝脏的生理与病理过程,这严重制约了其在基础研究与转化医学中的应用。为突破该瓶颈,葛广波与郭兆彬研究团队创新性地将重编程人肝样细胞、人脐静脉内皮细胞和人脐带间充质干细胞在三维系统中共同培育。经过系统优化,上述三种细胞成功自组装形成了具有CD31⁺血管网络和CK19⁺胆管样结构的肝脏类器官。相较于传统肝细胞类器官,该新型类器官不仅展现出更优异的白蛋白合成、糖原储存、药物转运与代谢等肝脏核心功能,其血管网络还能与体外芯片模型或宿主体内血管系统有效连接,实现功能性血液灌注。

基于3HLOs及其芯片平台,研究团队成功构建了高仿生的酒精性肝损伤模型。该模型准确模拟了酒精引发的氧化应激、线粒体功能障碍、肝细胞坏死及ALT/AST升高等典型肝脏病理特征。借助该模型,发现芹菜素、木兰花碱等天然产物具有良好的保肝活性,其药效与阳性对照药物非诺贝特相当。进一步借助酒精性肝损伤小鼠模型,验证了上述天然产物在动物整体水平的保肝作用,相关结果证实了3HLOs在保肝药物筛选与评价中的可靠性。更为重要的是,团队将3HLOs移植至终末期酒精性肝损伤小鼠体内后,其死亡率显著下降(从约90%降至25%),同时肝脏脂肪变性、肝损伤相关血清学指标等也大幅改善。机制研究表明:移植后的3HLOs通过建立的血管连接向宿主循环系统分泌人源急性期蛋白(如A1AT、AACT),这些蛋白发挥了抗炎与脂质调节作用,从而有效缓解了酒精引发的肝脏损伤。
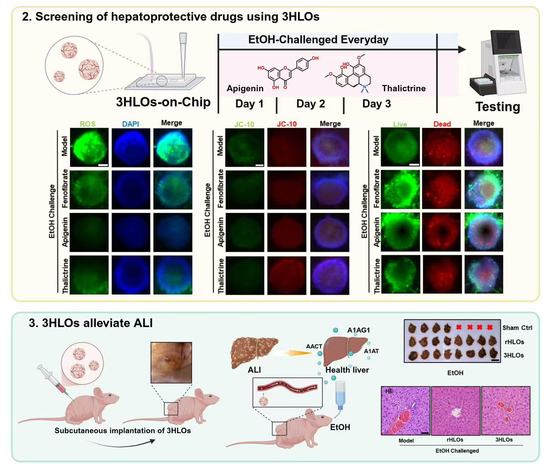
该研究通过构建具备功能性血管网络的新型人源肝脏类器官,不仅在类器官层面实现了人体肝脏的多种核心功能,还为高仿生肝脏疾病模型的构建、保肝药物的精准评价以及终末期肝脏疾病的再生医学治疗提供了新技术和新方法。未来,研究团队将进一步优化该人源肝脏类器官模型,拓展其在药源性肝损伤、非酒精性脂肪肝、肝纤维化等肝脏疾病研究中的应用,推动类器官技术在多领域中的创新应用。相关工作已同步申请了国家发明专利。我校交叉科学研究院博士研究生杨康迪为该论文唯一第一作者。葛广波研究员、郭兆彬青年研究员和德国柏林夏里特医学院研究员刘寒旸博士为该论文的共同通讯作者,上海中医药大学为该论文第一通讯单位。中国科学院上海药物研究所潘国宇教授团队和北京大学李晓辉教授团队为该研究提供了技术支持。该研究工作得到国家自然科学基金、国家重点研发计划等项目的支持。(科技处、交叉科学研究院)